El bioquímico Daniel López Serrano ha obtenido el XIII Premio Investigación Biomédica por sus trabajos sobre la resistencia bacteriana a los antibióticos, mientras que el también bioquímico Rubén Martín ha recibido el II Premio a las Ciencias y la Ingeniería por sus investigaciones sobre catálisis.

Las enfermedades infecciosas siguen siendo, a principios del siglo XXI, una de las causas más importantes de muerte en la humanidad1, aunque su contribución relativa ha ido disminuyendo desde el siglo XXI. La introducción de los antibióticos en la práctica clínica en la década de los cuarenta del siglo XX supuso una de las intervenciones más importantes para su control y aumentó en varios años la esperanza de vida de la población. De hecho, 3 premios Nobel de Medicina y Fisiología, de los años 1939, 1945 y 1952, lo son por descubrimientos de antibacterianos. Otras intervenciones importantes (vacunas, saneamiento del agua de bebida, mejoras higiénicas, mejoras en nutrición…) habían contribuido, desde bastantes años antes, a disminuir la prevalencia de las enfermedades infecciosas.
Los antibióticos han salvado millones de vidas, pero además han supuesto una revolución en la medicina. Han contribuido de forma muy significativa al progreso en campos como los trasplantes de órganos sólidos y de progenitores hematopoyéticos, la supervivencia de prematuros e inmunodeprimidos (naturales o por terapias farmacológicas), la cirugía de material protésico y los catéteres vasculares, donde las infecciones son especialmente prevalentes e importantes. Su aportación será mayor con el aumento de la esperanza de vida de la población.
Sin embargo, desde hace ya no pocos años, una amenaza creciente deteriora la eficacia de estos fármacos: la resistencia bacteriana a los antibióticos, que se define en este trabajo como la capacidad de una bacteria para sobrevivir en concentraciones de antibiótico que inhiben/matan a otras de la misma especie.
Si al poco de introducirse la penicilina en la práctica clínica la gran mayoría de las cepas de Staphylococcus aureus eran sensibles, actualmente lo son menos del 5-10%. De hecho, si el Penicillium que permitió a Fleming descubrir la penicilina hubiese contaminado muchos de los cultivos actuales de S. aureus, es más que dudoso que la hubiese descubierto. Cuando se introdujo en la clínica la cefotaxima a principios de la década de los ochenta del siglo XX todas la cepas de Escherichia coli y Klebsiella pneumoniae eran sensibles; hoy son resistentes el 13 y el 16%, respectivamente, de los aislamientos de hemocultivos en España. Cuando se comercializaron las fluoroquinolonas a mediados-finales de la década de los ochenta del siglo XX prácticamente todas las cepas de E. coli eran sensibles; hoy son resistentes el 34% de las de hemocultivos en España. El problema se agrava por los escasos recursos que dedica la industria farmacéutica a la investigación en antibiótico, lo que ha resultado en pocos nuevos y ninguno con mecanismo de acción diferente en los últimos años. Este desinterés se debe a varias cosas, que pueden resumirse en la poca rentabilidad de este grupo de fármacos en comparación con otros usados en terapia de enfermedades crónicas como la diabetes5 o de infecciones crónicas como la hepatitis por el virus de la hepatitisC, donde se han incorporado fármacos muy caros6.
Las infecciones causadas por bacterias resistentes se asocian a una mayor morbilidad7, mortalidad y coste del tratamiento que las causadas por bacterias sensibles de la misma especie. En un trabajo de infecciones por Klebsiella pneumoniae uno de los factores de riesgo de mortalidad estadísticamente significativo en el análisis univariable era la resistencia de la cepa a carbapenemas8, y en otro de muertes atribuibles a las enterobacterias productoras de carbapenemasas (EPC) se vio que eran significativamente más altas en pacientes infectados por estas9. En Europa en 2007 se calcularon 400.000 infecciones por bacterias multirresistentes y 25.000 muertes atribuibles10. En Estados Unidos las bacterias multirresistentes infectan a unos 2 millones de personas al año, de las que al menos 23.000 mueren11. El pronóstico de los pacientes con tuberculosis ultrarresistente a antibióticos (XDR en sus siglas en inglés) era malo a los 24 meses (46% de mortalidad) y a los 60 meses (73% de mortalidad), independientemente de estar o no coinfectados por el VIH12.
En Sudáfrica la tuberculosis resistente a antibióticos representa menos del 3% de los casos pero consume un tercio de los recursos asignados a esta enfermedad13. En Estados Unidos se calcularon en 2008 unos gastos sociales de entre 10,7 y 15 millones de dólares solo en 188 pacientes adultos de un hospital infectados por bacterias multirresistentes a antibióticos14.
El problema de la resistencia bacteriana ha traspasado las fronteras de la literatura médica y ha llegado a los medios de información general de todo el mundo con titulares como «The rise of antimicrobial resistance» (The New York Times, 10 de mayo de 2014); «Fleming tenía razón» (El País, 30 de abril de 2014); «La résistance aux antibiotiques devient une menace à l’échelle mondiale» (Le Monde, 3 de mayo de 2014); «Bacteria de pesadilla» (TV2, Documentos TV, 6 de abril de 2014).
El uso de concentraciones bajas de antibióticos en la dieta de animales se vio que se asociaba a una mayor ganancia de peso, por lo que los antibióticos se han usado de forma masiva como promotores del crecimiento de animales78, contribuyendo a la extensión de la resistencia. De hecho, en Estados Unidos se emplearon 3 millones de kilogramos de antibióticos en humanos en 2009 y 13 millones de kilogramos en animales en 2010, principalmente como promotores de crecimiento79.
Los antibióticos se emplean como profilácticos en acuicultura y agricultura, y algunos de ellos no son biodegradables. Han surgido bacterias resistentes a antibióticos en esos ambientes que han transferido sus genes a bacterias de animales y humanos80.
Otros factores de los humanos (edad, nutrición, estado inmune, antibióticos usados en variedad y cantidad…) también influyen en la dispersión81.
Podemos concluir que la presión selectiva de los antibióticos usados por el hombre (aunque no solo en el hombre, ya que estos constituyen bastante menos de la mitad) son la principal causa de la extensión de la resistencia a antibióticos, aunque, como previamente hemos visto, la relación es compleja.
Las posibles respuestas
La evolución de las bacterias es darwiniana: frente a los cambios (antibióticos en este caso), sobreviven las que mejor se adaptan. En las bacterias la adaptabilidad se debe a su plasticidad genética y su rápida replicación. El progreso de la resistencia bacteriana a los antibióticos es inevitable, pero se puede retrasar82. La resistencia puede ser reversible o casi cuando es rara; si es común, difícilmente; en un mundo globalizado es más difícil controlarla, se trata de una crisis global frente a la que no son suficientes medidas nacionales o locales.
/s3.amazonaws.com/arc-wordpress-client-uploads/infobae-wp/wp-content/uploads/2016/09/19201835/superbacteria-1920.jpg)
Si la presión selectiva es la causa más importante de la extensión de la resistencia, sería deseable que fuese la menor posible, y esto se consigue con un menor y más adecuado uso de los antibióticos. El uso de antibióticos en humanos es frecuentemente excesivo e inadecuado. El uso inapropiado de antibióticos es uno de los factores que contribuye al problema de la resistencia; el adecuado también, pero el primero es potencialmente mejorable. En Estados Unidos, pese a las evidencias y guías de práctica clínica, un 71% de las bronquitis agudas en adultos se trataron con antibióticos entre 1996 y 2010, con un aumento significativo a lo largo de los años83. En atención primaria en España, donde se consume el 85-90% del total de antibióticos usados en humanos, es posible y deseable una menor prescripción, aunque en los últimos años ha disminuido cuantitativamente84.
Los programas de optimización del uso de antibióticos (PROA) tienen como objetivo optimizar los tratamientos antimicrobianos para alcanzar los objetivos clínicos minimizando los efectos indeseables, entre los que se incluye la selección de bacterias resistentes. Cisneros et al.85 han demostrado que la implantación de un PROA con metodología no restrictiva consigue una mejora significativa en las prescripciones y una reducción del consumo, siendo además muy aceptado por los médicos prescriptores.
En un estudio en 6 países europeos se ha comprobado que un programa educativo por Internet reduce significativamente la prescripción de antibióticos en infecciones respiratorias86, aunque habría que ver que es lo que ocurre a largo plazo. Otra intervención educativa, tradicional, no por Internet, produjo resultados parecidos en Noruega87.
La prescripción de antibióticos es un proceso complejo en el que los prescriptores tienen diferente grado de entrenamiento, de motivación, de carga de trabajo y de conocimiento. La gran variabilidad hospitalaria de uso de antibióticos entre países europeos se explica principalmente por aspectos culturales (ideas sobre la salud, por ejemplo), aspectos socioculturales (sociedades más jerarquizadas o más igualitarias, por ejemplo) y aspectos socioeconómicos, y sobre ellos hay que incidir para lograr cambios88. La consulta con un especialista de enfermedades infecciosas es muy útil89.
Existen países, India por ejemplo, donde se pueden obtener antibióticos sin receta en las farmacias o incluso en lugares distintos de las farmacias, algo que debería prohibirse a nivel mundial; la crisis es global.
El uso de dosis altas de amoxicilina (80-90mg/kg/día) durante 5 días disminuye significativamente el riesgo de colonización nasofaríngea por neumococos no sensibles a penicilina al compararlo con el uso de dosis estándar (40mg/kg/día) durante 10 días90. Se ha observado en niños que tratamientos con dosis bajas de beta-lactámicos orales (inferiores a las recomendadas), o que duraban más de 5 días, aumentaban significativamente el riesgo de ser portador de neumococos no sensibles a penicilina91. Por tanto, en algunos casos una estrategia sería usar tratamientos cortos y dosis óptimas. Como indicaba Paul Ehrlich hace ya un siglo, en el 17 Congreso internacional de Medicina, el mejor modo de tratar una infección es «hit fast and hit hard» [golpea rápido y duro]. Otra posibilidad es acortar la duración de los tratamientos, buscar regímenes óptimos más cortos. Dunbar et al.92 demostraron la eficacia de un tratamiento corto con dosis más altas de las habituales de levofloxacino (750mg/día) en neumonía adquirida en la comunidad, un porcentaje importante de las cuales se clasificaban en las clasesiii, iv y v de Fine. Esto abre la posibilidad de acortar el tratamiento usando antibióticos y dosis que eliminen en un primer momento gran parte de la carga bacteriana.
Actualmente no hay suficientes datos para recomendar de forma habitual el uso cíclico de antibióticos como una medida para prevenir o reducir la resistencia a antibióticos en un periodo prolongado de tiempo93. Pero sí de la diversificación de antibióticos94,95, aunque la evidencia clínica es escasa. La diversificación debe basarse en un análisis de los datos globales disponibles en cada momento sobre patología infecciosa, resistencia bacteriana y actividad de los antibióticos por parte de todos los especialistas interesados, cada uno aportando sus datos y opiniones.
Los médicos muchas veces prescriben antibióticos por falta de pruebas diagnósticas rápidas y fiables que descarten una infección bacteriana. Aunque los datos que lo avalan son escasos, las pruebas rápidas para detectar bacterias multirresistentes a antibióticos parecen útiles96. Existe una técnica que distingue de manera rápida infecciones respiratorias víricas basándose en la respuesta inmune humana, con una sensibilidad del 89% y una especificidad del 94% en un estudio preliminar97. Necesita una validación clínica profunda pero es prometedora para disminuir el uso de antibióticos. En atención primaria, donde es más importante utilizar pruebas que predigan la evolución de la infección que conocer el agente etiológico, se ha demostrado que una prueba rápida de proteínaC reactiva reduce significativamente la prescripción de antibióticos en infecciones respiratorias, donde más se usan, sin comprometer la evolución clínica de los pacientes98. La identificación rápida de bacterias por MALDI-TOF y el uso de un PROA mejoran significativamente el tiempo para una terapia óptima y eficaz99.

En animales, el uso de antibióticos en piensos para profilaxis de infecciones y como promotores de crecimiento, donde suelen alcanzar concentraciones subinhibitorias, debería en general prohibirse100 o gravarse con un impuesto101, lo que reduciría significativamente el consumo (ya que en peso es la parte más numerosa del total) y el número de bacterias resistentes y de genes de resistencia en el medio ambiente. En la Unión Europea están prohibidos, pero no así en otros países, Estados Unidos por ejemplo, y el problema es global. Tras la prohibición de su uso como promotores de crecimiento por la Unión Europea en 1997 se observó una disminución de enterococos resistentes a vancomicina tanto en humanos como en animales102,103.
En un estudio en el que encontraban E. coli productor de BLEE en aguas residuales antes de la depuración vieron que la cantidad que finalmente quedaba dependía del método empleado en el tratamiento de las aguas73, lo que significa que con los métodos actuales o mejorados podría reducirse mucho la carga bacteriana que sale al medio ambiente.

La monitorización de la resistencia a antibióticos es relevante a nivel local, nacional y supranacional104. En algunas zonas, Europa por ejemplo, se hace muy bien105, pero como el problema es global, la vigilancia debe globalizarse.
Un alto porcentaje de infecciones nosocomiales se transmiten por las manos del personal sanitario106. El lavado de manos tiene un efecto evidente en enfermedades transmitidas por vía fecal-oral107, y la mejora de la limpieza y de la desinfección del material y del ambiente de los hospitales, junto con la higiene de las manos, reducen la transmisión de bacterias106. En los hospitales es clave la aplicación meticulosa de las medidas para la prevención y control de la infección, particularmente la higiene de manos108, para impedir la diseminación. Es preferible actuar cuando hay pocas personas colonizadas/infectadas; cuando hay muchas es más difícil. La eficacia de las medidas clásicas para controlar la selección y extensión de la resistencia es inversamente proporcional a la densidad de penetración de bacterias resistentes en un ambiente dado. Por tanto, sin nuevos antibióticos, es imprescindible reforzar las estrategias de control de la transmisión109-111. Pueden ser medidas económicamente costosas, pero costaría más no tomarlas. También es importante la vigilancia de pacientes que vienen de otros países o de otros centros con sospecha de bacterias multirresistentes112.
Los antibióticos son una clase única de fármacos por su impacto en la sociedad. Sería necesario concienciar a esta de la amenaza que representa la resistencia a antibióticos con una visión social y ecológica (los antibióticos como bien preciado finito). Son necesarias campañas educativas desde distintos frentes (administración, sociedades científicas, médicos, farmacéuticos, etc.) que contribuyan a cambios de actitud de los ciudadanos ante el consumo de antibióticos y el problema de la resistencia, buscando el compromiso de la sociedad. Se han realizado campañas de educación de pacientes y población general113,114 cuyo efecto es difícil de evaluar pero que parece positivo115.
Otra posibilidad es buscar alternativas terapéuticas a los antibióticos o productos que los complementen. Las vacunas previenen infecciones y por tanto reducen tratamientos. El uso generalizado de vacunas conjugadas frente al neumococo ha disminuido el número de infecciones invasivas, así como, por los serotipos que llevan, de cepas resistentes116, por reducción de la colonización faríngea por serotipos resistentes y bloqueo de la transmisión de esos serotipos. Las futuras vacunas frente al gonococo117 ayudarán a mitigar el problema de la resistencia en esta especie.
La terapia por bacteriófagos118 es una vieja idea, con poca evidencia clínica de eficacia. Una aproximación novedosa consiste en usar endolisinas derivadas de bacteriófagos, solas o modificadas (artelisinas), que hidrolizan la pared de grampositivos (endolisinas) y gramnegativos (artelisinas)119. Otras posibilidades (defensinas, anticuerpos monoclonales, agentes que interfieren mecanismos de patogenia, inmunoestimulantes, terapias antivirulencia, probióticos) tienen que demostrar su eficacia clínica.
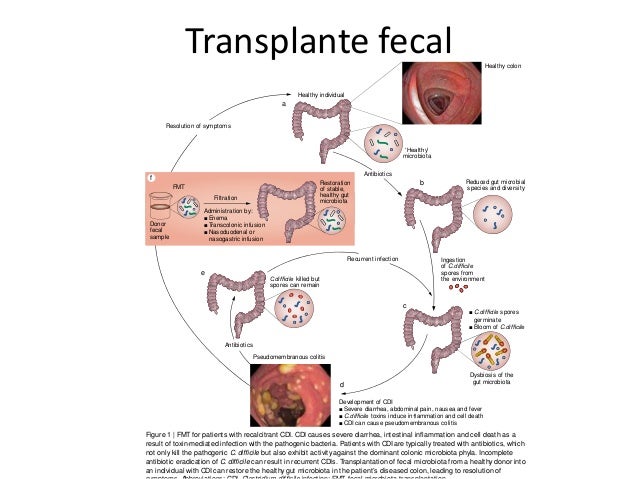
Sería interesante explorar las posibilidades de colaboración entre el sistema inmune y los antibióticos120, y sobre el papel de la microbiota comensal en el control y la erradicación de bacterias invasoras. El trasplante de microbiota fecal, usado en infección recurrente por Clostridium difficile121, puede adaptarse y ser una iniciativa a seguir.
Existen productos (eco-evo drugs), muchos de ellos en desarrollo, que podrían contrarrestar la penetración, la promiscuidad, la persistencia y la plasticidad de los clones eficaces que se están expandiendo rápidamente, de los elementos genéticos móviles y de los genes de resistencia122.
☆Basado en la ponencia del mismo título expuesta en Santander, en un curso de verano de la Universidad Internacional Menéndez Pelayo, el 24 de julio de 2014.
Copyright © 2014. Elsevier España, S.L.U. y Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica



Pingback: ¿CÓMO TIENES TU INTESTINO? ⋆ ENERGIA VITAL
Esta genial el articulo. Saludos.
Muchas gracias Alicia, un saludo.